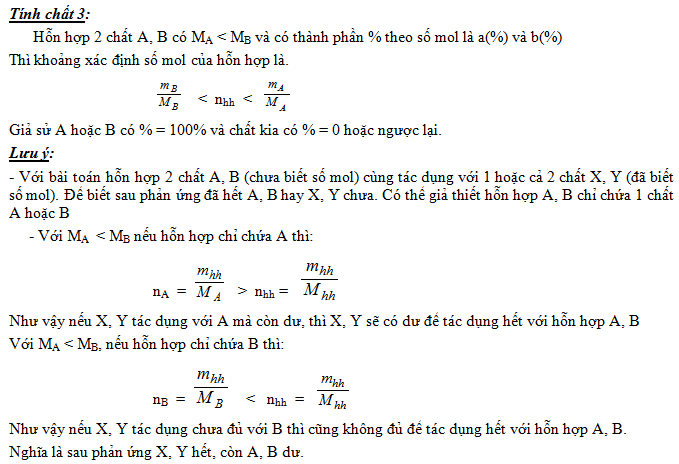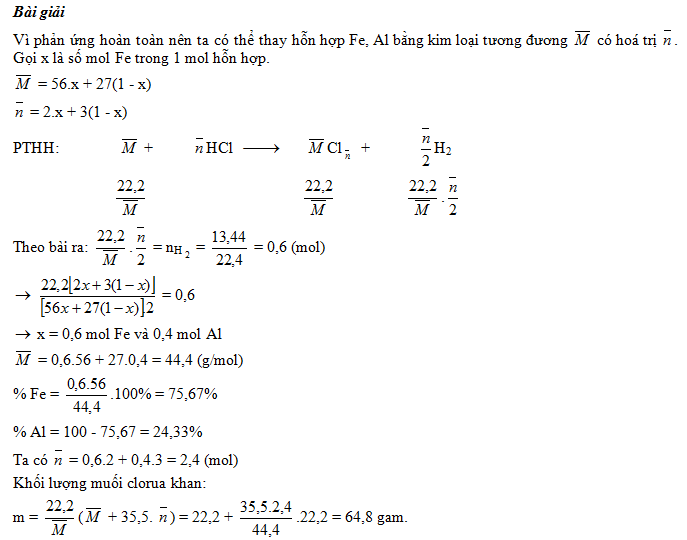PP số mol trung bình và xác định khoảng số mol
Cập nhật lúc: 14:00 01-06-2016 Mục tin: Hóa học lớp 9
Xem thêm:
CÁC BÀI TOÁN VẬN DỤNG SỐ MOL TRUNG BÌNH VÀ XÁC ĐỊNH KHOẢNG SỐ MOL
II. BÀI TẬP MẪU
Ví dụ 1: Cho 22,2 gam hỗn hợp gồm Fe, Al tan hoàn toàn trong HCl, ta thu được 13,44 lít H2 (đktc). Tính thành phần % khối lượng mỗi chất trong hỗn hợp và khối lượng muối clorua khan thu được.
Chú ý : Có thể áp dụng KLMTB của một hỗn hợp vào bài toán xác định tên kim loại. Thông thường đó là bài toán hỗn hợp hai kim loại thuộc 2 chu kỳ, hai phân nhóm kế tiếp, ...
Ví dụ 2: Khi cho 3,1 gam hỗn hợp hai kim loại kiềm thuộc hai chu kỳ liên tiếp tác dụng hết với nước ta thu được 1,12 lít H2 (đktc). Xác định hai kim loại và tính thành phần % theo khối lượng của hỗn hợp.
Bài 1. Cho 4,2g muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100ml dung dịch Ba(OH)2 0,46M thu được 8,274g kết tủa. Tìm công thức của muối và kim loại hoá trị II.
Đáp số:
TH1 khi Ba(OH)2 dư, thì công thức của muối là: CaCO3 và kim loại hoá trị II là Ca.
TH2 khi Ba(OH)2 thiếu, thì công thức của muối là MgCO3 và kim loại hoá trị II là Mg.
Bài 2: Hoà tan 23g một hỗn hợp gồm Ba và 2 kim loại kiềm A, B thuộc 2 chu kỳ kế tiếp nhau trong bảng tuần hoàn vào nước thu được dung dịch D và 5,6 lit H2 (đktc).
a/ Nếu trung hoà 1/2 dung dịch D cần bao nhiêu ml dung dịch H2SO4 0,5M? Cô cạn dung dịch thu được sau khi trung hoà thì được bao nhiêu gam muối khan?
b/ Nếu thêm 180ml dung dịch Na2SO4 0,5M vào dung dịch D thì chưa kết tủa hết được Ba(OH)2. Nếu thêm 210ml dung dịch Na2SO4 0,5M vào dung dịch D thì dung dịch sau phản ứng còn dư Na2SO4. Xác định 2 kim loại kiềm ở trên.
Đáp số:
a/ mhh muối = 23,75g
b/ 2 kim loại kiềm là Na và K.
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
-
Dạng toán kim loại tác dụng với nước(16/06)
Những kim loại nào tác dụng được với nước? Kim loại tác dụng với nước bao gồm các dạng bài nào? Phương pháp giải của từng dạng bài đó? Tất cả sẽ được đề cập trong bài viết dưới đây.
-
Tách-tinh chế kim loại, hợp chất của kim loại(02/06)
Các bài tập tách và tinh chế kim loại giúp các em khắc sâu kiến thức về kim loại.
-
Dạng toán khử oxit kim loại(01/06)
Bài toán dạng khử oxit kim loại là dạng bài tập khá hay, thường xuyên gặp, để giải dạng bài tập này ta thường sử dụng phương pháp bảo toàn khối lượng và chú ý hiệu suất phản ứng (nếu có).
-
Nhận biết kim loại và hợp chất của kim loại(01/06)
Bài tập nhận biết là dạng bài tập phổ biến trong các bài thi và bài kiểm tra, để làm được dạng bài này ta cần nhớ các phản ứng đặc trưng của mỗi chất.
-
Bài toán phản ứng nhiệt nhôm(01/06)
Bài viết hướng dẫn bạn đọc cách giải các bài tập về phản ứng nhiệt nhôm cơ bản với các ví dụ minh họa dễ hiểu.
-
Dạng toán biện luận về kim loại(01/06)
Dạng toán biện luận về kim loại là một dạng toán khó, đòi hỏi học sinh có kiến thức chắc chắn, tư duy linh hoạt.
-
Dạng toán chứng minh axit còn dư(01/06)
Dạng toán chứng minh lượng dư nói chung và chứng minh axit dư nói riêng là một dạng bài vô cùng phổ biến trong các kì thi. Cùng tìm hiểu cách giải quyết vấn đề khi gặp dạng bài này như thế nào?
-
PP dùng mốc so sánh trong toán về kim loại(01/06)
Một phương pháp khá hay và linh hoạt. Giúp học sinh giải quyết các bài toán khó về kim loại
-
Bài tập nhiệt nhôm nâng cao(31/05)
Bài viết giúp bạn đọc có phương pháp giải nhanh và hiệu quả các bài toán nhiệt nhôm khó.
-
Bài tập xác định công thức oxit sắt nâng cao(31/05)
Bài viết dưới đây hướng dẫn bạn đọc giải các bài tập tìm công thức oxit của sắt hay và khó thường gặp trong các đề thi học sinh giỏi.