Sắt
Cập nhật lúc: 16:20 23-10-2015 Mục tin: Hóa học lớp 12
Xem thêm:
KIM LOẠI SẮT
1. Vị trí – cấu hình e – tính chất vật lí:
- Fe thuộc ô 26, chu kì 4, nhóm VIIIB
- Cấu hình e: 1s2 2s22p63s23p63d6 4s2, => Fe là nguyên tố d, có 2e ngoài cùng, 8e hoá trị
- Fe là kim loại nặng, dễ rèn, màu trắng hơi xám, có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ ( khác với các kim loại khác), Fe có cấu tạo mạng tinh thể lập phương tâm diện hoặc tâm khối tuỳ vào nhiệt độ
2. Tính chất hoá học: Fe là kim loại có tính khử trung bình
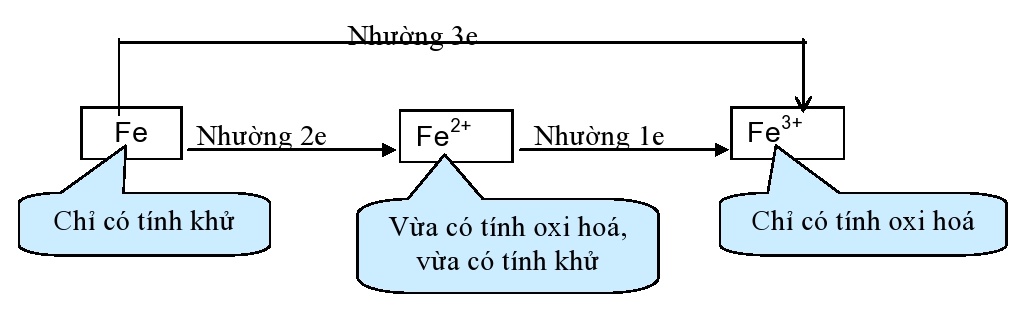
Các phương trình phản ứng
a Tác dụng với phi kim:
Fe + S \(\rightarrow\) FeS
3Fe + 2O2 \(\rightarrow\) Fe3O4, ( Có thể tạo ra hỗn hợp sản phẩm FeO, Fe2O3....)
2Fe + 3Cl2 \(\rightarrow\) 2FeCl3
b) Tác dụng với axit Fe \(\rightarrow\) Fe2+ + H2
Fe \(\rightarrow\) Fe3+ + sp khử của \(\rightarrow\) + H2O (*)
- Đối với phản ứng (*) nếu Fe dư thì Fe + 2Fe3+ \(\rightarrow\) 3Fe2+
- Fe thụ động trong HNO3 đặc nguội hoặc H2SO4 đặc nguội
c) Tác dụng với dung dịch muối: Fe bị oxi hoá thành Fe2+
Fe + 2AgNO3 \(\rightarrow\) Fe(NO3)2 + 2Ag (1)
d) Tác dụng với nước
* Ở nhiệt độ thường Fe không phản ứng với nước, nhưng Fe bị tan trong nước có khí oxi
4Fe + 6H2O + 3O2 \(\rightarrow\) 4Fe(OH)3
* Ở nhiệt độ cao( >5700) Fe + H2O \(\rightarrow\) FeO + H2
Ở nhiệt độ cao (<5700) 3Fe + 4H2O \(\rightarrow\) Fe3O4 + 4H2
3.Điều chế:
·FeCl2 \(\rightarrow\) Fe + Cl2↑
·FeSO4 + H2O \(\rightarrow\) Fe+ O2↑+ H2SO4
·FeSO4 + Mg \(\rightarrow\)Fe + MgSO4
·FeO + H2 \(\rightarrow\)Fe + H2O
·Fe3O4 + 4CO \(\rightarrow\)Fe + 4CO2↑
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
-
Sơ lược một số kim loại(29/10)
Bài viết đưa ra những kiến thức ngắn gọn nhất về các về một số kim loại như bạc, thiếc,...
-
Đồng và hợp chất của đồng(28/10)
Đồng nằm sau H trong dãy điện hóa và là kim loại khá phổ biến trong tự nhiên vậy nó có những tính chất gì? Bài viết này hệ thông chi tiết các kiến thức lý thuyết về đồng cùng hợp chất của nó.
-
Hợp chất của crom(27/10)
Với nội dung ngắn gọn, cô đọng xúc tích bài viết sẽ đưa đến cho bạn những kiến thức trọng tâm nhất về các hợp chất của crom.
-
Crom - Đầy đủ lý thuyết và bài tập có đáp án(26/10)
Crom là một kim loại cứng, mặt bóng, màu xám thép với độ bóng cao và nhiệt độ nóng chảy cao do đó được ứng dụng nhiều trong đời sống, vậy ngoài những tính chất vật lý trên crom còn có tính chất hóa học gì? Được điều chế như thế nào? Có ứng dụng ra sao cùng tìm hiểu qua bài viết này.
-
Hợp chất của sắt(24/10)
Cùng tìm hiểu tính chất hóa học, điều chế và ứng dụng các hợp chất của săt qua bài viết.

