Độ tan của một chất trong nước
Cập nhật lúc: 15:00 24-05-2016 Mục tin: Hóa học lớp 8
Xem thêm:
ĐỘ TAN CỦA MỘT CHẤT TRONG NƯỚC
I. LÝ THUYẾT CẦN NHỚ
1. Chất tan và chất không tan
- Nếu 100 gam nước hòa tan:
> 10 gam chất tan → chất dễ tan hay chất tan nhiều.
< 1 gam chất tan → chất tan ít.
< 0,01 gam chất tan → chất thực tế không tan.
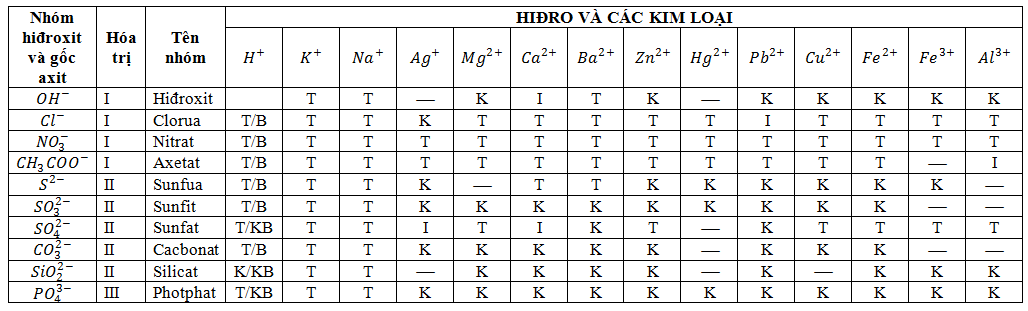
2. Tính tan của các hợp chất trong nước
- Bazơ: phần lớn các bazơ không tan, trừ NaOH, KOH, Ba(OH)2.
- Axit: hầu hết các axit tan được, trừ H2SiO3.
- Muối: Các muối nitrat đều tan.
+Phần lớn các muối clouaa và sunfat tan được, trừ AgCl, PbSO4, BaSO4.
+ Phần lớn muối cacbonat không tan trừ Na2CO3, K2CO3.
Ta có bảng tính tan của một số hợp chất sau:
Chú thích: K : không tan
T: Tan
KB: không bền
K: bền
3. Độ tan của một chất trong nước
a. Định nghĩa
- Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
VD: ở 25oC :
+ SNaCl = 36 g
+ S đường mía= 204 g
b. Yếu tố ảnh hưởng tới độ tan
- Độ tan của chất rắn trong nước: khi nhiệt độ tăng thì độ tan tăng và ngược lại.
- Độ tan của chất khí trong nước: độ tan của chất khi trong nước sẽ tăng nếu ta giảm nhiệt độ và áp suất.
II. BÀI TẬP CỦNG CỐ
Bài 1. Hãy chọn câu trả lời đúng.
Độ tan của một chất trong nước ở nhiệt độ xác định là:
A. Số gam chất đó có thể tan trong 100 gam dung dịch
B. Số gam chất đó có thể tan trong 100 gam nước.
C. Số gam chất đó có thể tan trong 100 gam dung môi để tạo thành dung dịch bão hòa.
D.Số gam chất đó có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa. Bài giải:
Bài 2. Khi tăng nhiệt độ thì độ tan của các chất rắn trong nước:
A. Đều tăng
B. Đều giảm
C. Phần lớn là tăng
D. Phần lớn là giảm
E. Không tăng và cũng không giảm.
Bài 3. Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước:
A. Đều tăng
B. Đều giảm
C. Có thể tăng và có thể giảm
D. Không tăng và cũng không giảm.
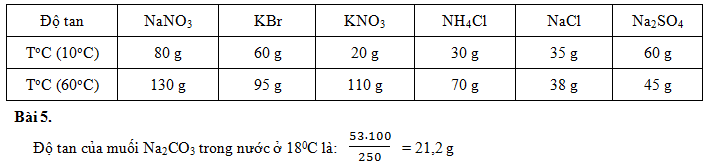
Bài 4. Dựa vào đồ thị về độ tan của các chất rắn trong nước (hình 6.5), hãy cho biết độ tan của các muối NaNO3, KBr, KNO3, NH4Cl, NaCl, Na2SO4 ở nhiệt độ 10oC và 60oC.
Bài 5. Xác định độ tan của muối Na2CO3 trong nước ở 180C. Biết rằng ở nhiệt độ này khi hòa tan hết 53 g Na2CO3 trong 250 g nước thì được dung dịch bão hòa.
LỜI GIẢI VÀ ĐÁP ÁN
Bài 1.
Đáp án : D đúng.
Bài 2.
Đáp án : C đúng
Bài 3.
Đáp án : A đúng
Bài 4.
Từ điểm nhiệt độ 10oC và 60oC ta kẻ những đoạn thẳng song song với trục độ tan (trục đứng), tại giao điểm của những đoạn thẳng này với các đồ thị ta kẻ những đoạn thẳng song song với nhiệt độ (trục ngang) ta sẽ đọc được độ tan của các chất như sau:
+ Độ tan NaNO3: ở 10oC là 80 g, ở 60oC là 130 g
+ Độ tan KBr: ở 10oC là 60 g, ở 60oC là 95 g
+ Độ tan KNO3: ở 10oC là 20 g, ở 60oC là 110 g
+ Độ tan NH4Cl: ở 10oC là 30 g, ở 60oC là 70 g
+ Độ tan NaCl: ở 10oC là 35 g, ở 60oC là 38 g
+ Độ tan Na2SO4: ở 10oC là 60 g, ở 60oC là 45 g
Ta có thể kẻ bảng:
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
-
BTTN nồng độ dung dịch(25/05)
Tổng hợp các bài tập trắc nghiệm về nồng độ dung dịch với đầy đủ các dạng bài tập giúp bạn đọc ôn kỹ lại kiến thức về nồng độ dung dịch và các phương pháp giải dạng bài tập này.
-
Pha trộn 2 dd có xảy ra phản ứng(25/05)
Pha trộn 2 dd có xảy ra phản ứng là dạng toán cực hay xong cũng cực khó nếu ta không xác định được 2 dung dịch đó phản ứng với nhau thu được chất nào và xác định được thành phần dung dịch sau phản ứng. Bài viết sẽ hướng dẫn chi tiết tỉ mỉ cách giải dạng bài này với những ví dụ cực dễ hiểu.
-
Bài toán hòa tan một chất vào nước hay một dd cho sẵn(25/05)
Bài toán hòa tan 1 chất vào nước hay dd cho sẵn sẽ là một trong những bài toán quen thuộc mà chúng ta sẽ được học ở chương trình hóa học phổ thông, vậy đối với chương dung dịch dạng bài này được giải như thế nào? Khi giải cần chú ý gì? Cùng xem bài viết dưới đây để hiểu rõ phương pháp giải cũng như cách trình bày dạng toán này.
-
Nồng độ dung dịch(24/05)
Nồng độ phần trăm, nồng độ mol của 1 dung dịch là gì? Bài viết dưới đây sẽ giúp chúng ta hiểu được khái niệm, ý nghĩa của nồng độ phần trăm, nồng độ mol, biết vận dụng công thức tính nồng độ phần trăm, nồng độ mol của dung dịch và những đại lượng liên quan đến dung dịch để làm các bài tập.
-
Pha chế dung dịch(24/05)
Qua bài nồng độ dung dịch chúng ta đã biết được cách tính toán nồng độ dung dịch. Vậylàm thế nào để pha chế được 1 dung dịch theo nồng độ đã biết, cách pha loãng 1 dung dịch như thế nào?
-
LT Dung dịch(24/05)
Trong thí nghiệm hoá học hoặc trong đời sống hàng ngày các em thường hoà tan nhiều chất như đường, muối... trong nước, ta có những dung dịch đường, muối. Vậy dung dịch là gì? Cùng tìm hiểu bài dưới đây
-
Bài tập độ tan-nồng độ dung dịch(24/05)
Tính độ tan và nồng độ dung dịch là 2 dạng bài tập thường gặp ở chương dung dịch, độ tan và nồng độ dung dịch đều liên quan đến chất tan chỉ khác độ tan chia cho khối lượng dung môi còn nồng độ dung dịch chia cho khối lượng dung dịch. Vậy dung môi khác dung dịch ở điểm nào? Bài viết dưới đây sẽ giải đáp giúp bạn.
-
BT trắc nghiệm tổng hợp dung dịch(24/05)
Bài viết hệ thống đầy đủ, xúc tích, khoa học về các câu hỏi lý thuyết cũng như các dạng bài tập về dung dịch
-
Dạng toán pha trộn 2 dung dịch không xảy ra phản ứng(24/05)
Pha trộn dung dịch gồm 2 dạng chính đó là dạng pha trộn dd 2 hay nhiều chất nhưng chúng không phản ứng với nhau và pha trộn dd 2 hay nhiều dd nhưng có xảy ra phản ứng. Dạng bài tập pha trộn dd mà chúng không phản ứng với nhau thường giải theo 2 cách: bảo toàn khối lượng và pp đường chéo. Các ví dụ dưới đây sẽ giúp bạn đọc hiểu rõ pp giải dạng bài này.
-
BT về độ tan và tinh thể hiđrat(24/05)
Bài viết nhằm mục đích giúp học sinh khắc sâu kiến thức về độ tan, đồng thời rèn luyện kĩ năng giải bài tập về độ tan và tinh thể hiđrat